NKGen Biotech公司在马萨诸塞州波士顿举行的阿尔茨海默病临床试验(CTAD)年会上,报道了NK细胞疗法SNK01治疗阿尔茨海默病(AD)患者的I期试验数据。

在治疗开始11周后,90%的患者表现出改善或维持稳定的认知功能阿尔茨海默病综合评分。
静脉注射NK细胞——SNK01有可能能穿过血脑屏障,减少脑脊液(CSF)中β42/40和pTau181水平和神经炎症。
该报告“用活性增强的扩增非遗传修饰NK细胞(SNK01)治疗阿尔茨海默病受试者——I期剂量递增研究”,提供了单中心、开放标签、I期研究的结果,该研究评估了SNK01在阿尔茨海默病患者中的安全性、耐受性和探索性疗效。
SNK01是一款非基因修饰的自体NK细胞疗法,其在采集患者的血液后从中分离并筛选出目标NK细胞,再激活NK细胞并促使其扩增。SNK01具有增强的细胞毒性和激活受体表达,加之NKGen独有的冷冻保存工艺,可以使细胞保持显著的活性和细胞毒性。
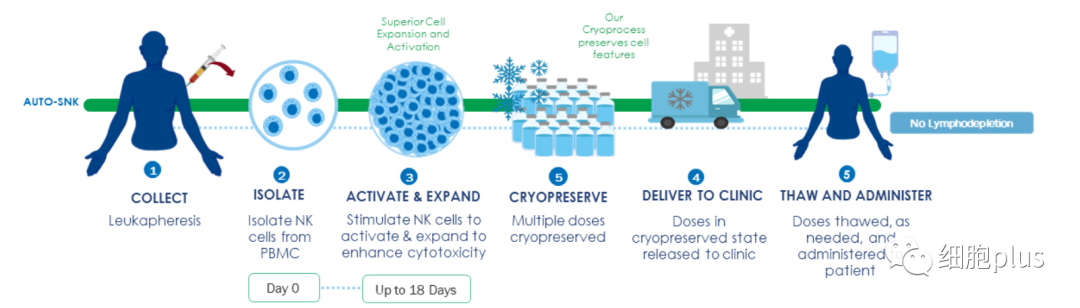
SNK01每三周通过静脉注射(IV)一次,共进行四次治疗,采用3 + 3剂量递增设计(1,2 & 4 x10^9)。主要终点是安全性,次要终点包括认知评估和生物标志物水平的变化。
NKGen Biotech首席执行官Paul Y. Song医学博士表示:“我们很高兴公布我们的第一期阿尔茨海默氏病研究的最终数据,进一步证明SNK01耐受性良好,似乎可以减少试验患者的蛋白质(pTau181和Aβ42/40)和神经炎症(GFAP)。值得注意的是,尽管基线MMSE评分的中位数为14,但90%的患者在11周后表现出改善或保持稳定的认知功能,这表明SNK01可能不仅仅是减缓疾病进展。”
Paul Y. Song博士继续说,“当我们第一次提出使用我们增强的NK细胞治疗神经退行性疾病时,我们遭到了质疑。但是,感谢Angeles医院的临床团队,他们与我们合作,获得了联邦卫生保护委员会和研究伦理委员会的完全批准,我们得以进行这项开创性的试验,为我们提供了宝贵的临床和生物标记数据,这无疑帮助我们获得了美国IND对中度AD患者进行I/IIa期研究的许可。鉴于该I期试验是一项剂量递增试验,仅在11周内给予4次总剂量,我们新的IND批准要求使用更高的剂量和延长的给药方案。我们很高兴开始下一阶段,希望为更多晚期患者建立一种全新的治疗模式。”

报告展示的亮点:
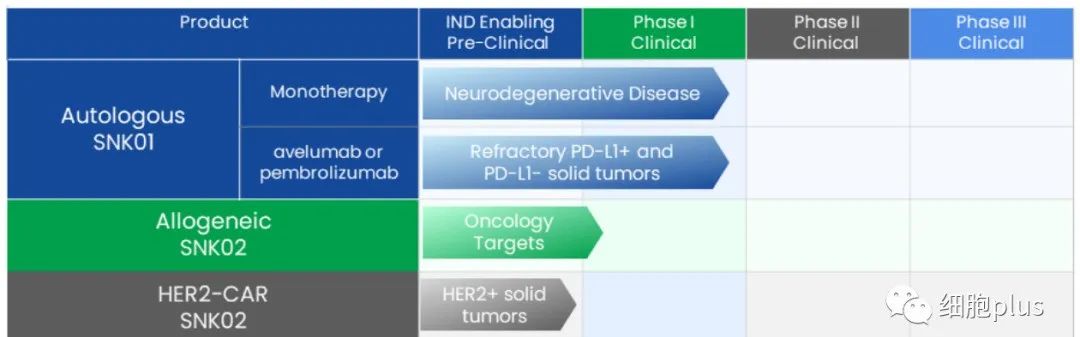
同时根据该公司最新公告,除了自体SNK01在获得FDA批准IND临床试验的同时,他们也开启了异体NK细胞产品SNK02的I期临床试验,已有实体瘤患者入组进行治疗。