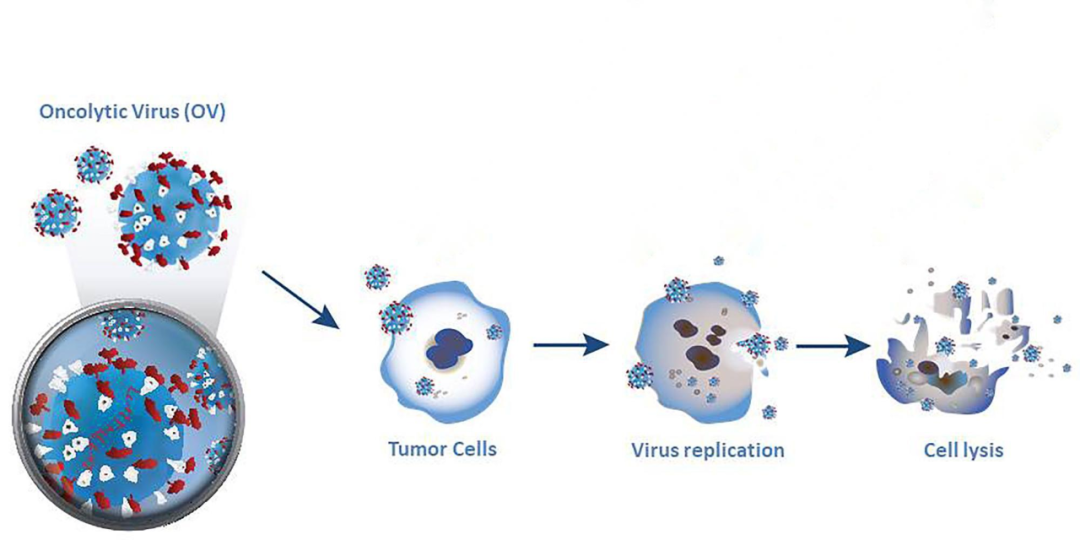
2024年1月25日,溶瘤病毒生物科技公司CG Oncology在纳斯达克上市,当天最高涨幅超过100%,市值超20亿美元。溶瘤病毒再次吸引了医药工业界的目光。溶瘤病毒是以删除致病序列的结构改造型病毒为载体进行构建,可以选择性地感染肿瘤细胞并在肿瘤组织内复制,溶解和破坏肿瘤,而对正常组织不造成损伤。
截至2023 年5 月, 全球已批准4款溶瘤病毒产品上市:2004年,Latima 公司开发的ECHO-7( 商品名:Rigvir) 在拉脱维亚获得批准,用于治疗黑色素瘤;2005 年,上海三维生物公司开发的H101(商品名:安柯瑞)在中国获得批准,用于治疗鼻咽癌和头颈部癌;2015 年,Amgen 公司开发的T-VEC( 商品名:Imlygic)在美国获得批准,用于治疗黑色素瘤,随后该产品在欧盟也获得批准;2022 年, 第一三共株式会社(Daiichi Sankyo)开发的G47Δ(商品名:Delytact)在日本获得批准,用于治疗恶性胶质瘤。同时,近年来我国批准的用于各类恶性肿瘤临床试验的溶瘤病毒产品数量也迅速增加。为规范溶瘤病毒产品的研发和申报,国家药品监督管理局药品审评中心(CDE)于2023 年2 月正式发布了《溶瘤病毒产品药学研究与评价技术指导原则(试行)》。该指导原则的出台,为溶瘤病毒产品的研发、评价及申报提供了明确的指导方向。

eMedClub
溶瘤病毒的生产用物料直接关系到产品的安全性和有效性,需要建立良好、规范的质量管理体系。
溶瘤病毒生产原材料主要为病毒,为了确保产品质量的一致性和稳定性,生产用病毒需采用种子批系统管理。在病毒种子批建立过程中,需采用合理的筛选技术进行病毒的单克隆筛选。病毒种子批建立过程中可能使用到的初始病毒需进行适当的研究和质量控制。
病毒种子批建立后,需开展相应的检定。检定项目应符合《中国药典》或其他通行技术指导原则的相关规定,并根据病毒种子自身特点设定相应的检定项目。检定项目一般包括鉴别(基因序列、血清型、电镜形态等)、病毒滴度、外源因子(细菌、真菌、支原体、分枝杆菌(如适用)、病毒等)、初始病毒(或野生型病毒)、功能性检测(如肿瘤选择性、病毒复制能力、裂解/杀伤肿瘤细胞能力等)、抗病毒药物敏感性(如适用)、目的蛋白鉴定和功能检测(如适用)、病毒物理特性(如适用)等。
溶瘤病毒产品类型较多,基因设计、生物学特性和作用机制情况复杂,使用到的生产/包装细胞类型多样,生产工艺和质量研究也各有不同,因此,对于不同类型的溶瘤病毒产品,可基于质量风险特征制定相应的控制措施。溶瘤病毒产品质量相关风险一般包括以下方面:(1)对病毒传染性、致病性和毒力等研究和认识不足, 缺乏相应的风险控制而引入的风险。(2)病毒基因修饰和/或多次传代导致病毒发生基因突 变的风险,以及病毒基因插入细胞基因组致癌的风险。(3)对细胞基质认知不够充分、检定项目不全面以及肿瘤细胞、宿主细胞 DNA 和宿主蛋白质残留的风险。(5)生产过程中添加的生产用原材料,尤其是动物/人源材料外源因子控制不全面的风险由于溶瘤病毒产品具有复制能力的特性,在生产过程中容易与引入的外源病毒结合发生异变,因此对于外源病毒因子的检测与控制就尤为关键。由于溶瘤病毒具有复制能力,因而外源病毒因子检测和控制存在一定挑战,常见的控制策略包括:细胞库、病毒种子批以及生产过程中使用的生产用原材料需进行外源病毒因子的全面检测和控制。生产过程中使用的动物/人源材料应结合原材料来源进行特异性病毒检测,如人源性病毒、牛源性病毒、猪源性病毒等,病毒检测种类应全面,检测方法应满足要求。选择生产过程中最适阶段的样品(如未处理的培养收获液)进行外源病毒因子的检测和控制,开展相应研究以说明生产过程中检测阶段制定的合理性。在一些情况下,需要结合具体产品的情况,根据研究与验证结果,与以下控制相结合或相互补的控制策略,如:病毒去除/灭活工艺步骤、放行检测(必要时,还可考虑在原液/成品中进行外源病毒因子检测)。中和抗体:病毒种子批的外源病毒因子检测可通过加入中和抗体消除溶瘤病毒对检测结果的影响,中和抗体的选用应避免抗血清中存在中和潜在外源病毒因子的抗体,使用的中和抗体量应为完全中和溶瘤病毒的最低使用量,并且检测样品的浓度应合理且有研究依据,避免检测样品被度稀释造成检测灵敏度降低的风险。如因中和抗体不能充分中和溶瘤病毒,检测结果受到干扰时,可在病毒种子生产中设置对照细胞。二代测序:聚合酶链反应(PCR)等敏感检测技术也可排除特异性的外源病毒因子污染的风险,但可能无法发现整个基因组序列中的其他非预期突变。建议采用基因测序技术对代表性工艺的一个或若干批次进行全基因组测序,尽可能在早期阶段积累较多的数据。建议在临床申报阶段对病毒种子开展遗传稳定性研究,确认达到一定代次的病毒基因组与主种子批或工作种子批基因组序列一致。目前一代测序( 如Sanger法) 虽然具有测序长度可达1 000 bp和准确率高等优点,但测序成本较高、时间长且通量低,在应用于溶瘤HSV 测序时,因其基因组的复杂性,使得采用一代测序技术存在较大局限,由此考虑采用二代测序(NGS) 深入分析基因组序列差异。(1)生产工艺相关操作对病毒理化特性、生物学活性等 产生不良影响的风险。(2)分子变体、非完整包装病毒(如非包膜病毒颗粒、 空壳病毒颗粒等)、错误包装病毒颗粒、无活性病毒颗粒、病毒颗粒聚集体、生物学活性等分析方法受限或变异性较大引入的风险。基于以上质量相关风险,应制定相应的风险控制策略。例如,针对生产用物料的风险应进行全面的研究和风险评估,对生产工艺进行充分研究和验证,结合不同病毒特点开展全面的质量研究和质量控制,并对质量控制方法进行全面验证。
2023年,《溶瘤病毒产品药学研究与评价技术指导原则(试行)》正式出台,为溶瘤病毒产品的研发、评价及申报提供了明确的指导方向。
溶瘤病毒产品的安全性和有效性与其生产用物料紧密相连。因此,建立规范的质量管理体系显得尤为重要。其中,病毒种子批的系统管理是关键环节,尤其是初始病毒种子批的建立和检定工作更为重要。病毒种子批的检定方法多种多样,具体的操作方式和应用场景也各有不同。
溶瘤病毒IND阶段的安全性和质量可控性研究是药物走向后期的有效保证。在质量风险控制中,外源病毒因子的检测与控制是重点和难点。目前,中和抗体和NGS等新方法的出现,为这一领域的深入研究提供了新的途径。